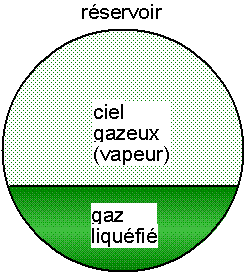
Fig. 1 Réservoir rempli d'un gaz liquéfié avec un ciel gazeux sous pression
| précédent |
Cette page reprend les information publiées dans le document Analysis of Boiling Liquid Expanding Vapor Explosion (BLEVE) Events at DOE Sites (fichier PDF, 20p)1 de Michael W. Roberts. Les données et résultats ont été convertis en unités internationales et mis sous forme de graphique, avec le risque d'erreur que cela comporte de ma part.
Vous pouvez m'écrire à l'adresse suivante
pour m'adresser vos remarques, critiques, corrections et suggestions :
cdang@wanadoo.fr
L'«ébullition-explosion» (NB : ce n'est pas la dénomination officielle) se produit lors de la rupture d'un réservoir contenant un liquide sous pression. C'est un accident très redouté dans le cas de feux de camion-citerne ou de réservoir d'hydrocarbures, surtout lorsqu'il s'agit de gaz liquéfiés : gaz naturel, propane, butane, GPL (gaz de pétrole liquiéfié)... En effet, dans ce cas-là, il peut s'accompagner d'une boule de feu produisant une chaleur extrême. Son nom anglais est B.L.E.V.E. : boiling liquid expanding vapour explosion, c'est à dire «explosion de vapeur en expansion par ébullition d'un liquide».
| début |
La BLEVE se produit avec un réservoir qui contient un liquide sous pression, liquide qui, s'il n'était pas sous pression, serait à l'état gazeux ; le réservoir n'est jamais complètement rempli, il y a un «ciel gazeux» qui maintient cette pression. C'est par exemple le cas du dioxyde de carbone liquide, des GPL ou de l'oxygène liquide à température ambiante (environ 20 °C). La BLEVE survient lorsque le réservoir qui contient le liquide se rompt. Cette rupture peut être due à un choc (accident de la circulation d'un camion-citerne, déraillement d'un wagon-citerne, impact), à une mauvaise manipulation (sur-remplissage du réservoir), ou à une fragilisation (corrosion, gel).

Fig. 1 Réservoir rempli d'un gaz liquéfié
avec un ciel gazeux sous pression
Donc, une fissure se crée. Au niveau de cette fissure, la pression de l'air, qui était à pression atmosphérique (environ 1 bar), passe brusquement à la pression du réservoir (typiquement plusieurs dizaines à centaines de bar), il y a donc une première onde de surpression, un «bang».
Puis, le gaz s'échappe par cette fissure, sous la forme d'un jet. La pression baisse donc rapidement dans le réservoir, le liquide se met à bouillir, non pas sous l'effet de la chaleur, mais sous l'effet de la chute de pression (un peu comme les bulles de soda qui se forment à l'ouverture de la bouteille, bien que le phénomène soit différent). Puisque le liquide bout, il se transforme rapidement en gaz, et la pression augmente de manière très importante dans le réservoir. Par ailleurs, le jet de gaz peut entraîner des goutelettes (aérosol), qui viennent gêner l'échappement du gaz et contribuent ainsi à la montée en pression. Cette repressurisation catastrophique provoque la propagation de la fissure puis la rupture totale du réservoir avec une deuxième onde de surpression - c'est la BLEVE.

Fig. 2 Deux ondes de pression, par détente du ciel gazeux
puis par ébullition violente
| début |
Dans les cas les plus graves, la rupture du réservoir est due à un échauffement par un feu extérieur, par exemple lorsqu'une une mare de produit enflammé se répend sous le réservoir, par un jet de feu provenant d'un réservoir voisin, ou bien lorsque des flammes viennent lécher les parois du réservoir. Sous l'effet de la chaleur, le liquide dans le réservoir se met à bouillir, la pression dans le réservoir augmente ; le gaz s'échappe alors par une valve de surpression (soupape de sécurité), pouvant produire à cette occasion un jet de feu. Le niveau de liquide baisse donc dans le réservoir.
Le gaz conduisant bien moins la chaleur que le liquide2, la partie de la paroi du réservoir qui se trouve au-dessus du liquide s'échauffe de manière très importante (dans la partie basse, la chaleur de la paroi est évacuée de l'autre côté par la convection du liquide). La paroi surchauffée s'affaiblit, puis finit par se rompre, provoquant l'accident.
On voit que par rapport au cas précédent, c'est la soupape qui joue le rôle de la fissure initiale. Il ne faut pas en déduire que la soupape a un rôle néfaste, bien au contraire : comme la température monte, la pression monte de toutes manières, la soupape permet de retarder l'accident et de laisser plus de temps aux secours pour évacuer et combattre le sinistre. Elle peut même empêcher l'explosion.
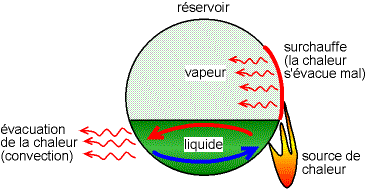
Fig. 3 Mécanisme de surchauffe et de rupture du réservoir -
évacuation de la chaleur par convection et par rayonnement
Lorsque la paroi se rompt, il y a :
Il faut donc s'attendre à des blessures dues à l'effet de souffle (blast), à des brûlures par radiation, ainsi qu'à des traumatismes associés : chute, projection d'éclats (shrapnells : bouts de verre, éclats métalliques, pierres), écroulement d'un mur ou d'un toit.

| début |
Lorsque le réservoir est muni d'une valve de surpression, et que la BLEVE est due au feu, la pression régnant à l'intérieur du réservoir au moment de l'explosion est environ 20 % supérieure à la pression de déclenchement de la valve (l'évacuation des gaz par la valve n'est pas assez rapide ne suffit pas à empêcher l'augmentation de pression ; par ailleurs, le réservoir est affaibli par la chaleur et rompt plus facilement). Lorsqu'il n'y a pas de valve, ou bien que celle-ci est mal dimensionnée, la pression au moment de l'explosion est la pression de rupture du réservoir (l'augmentation de pression est très rapide, le réservoir n'a pas le temps d'être affaibli par la chaleur, il se rompt à une pression plus forte).
La boule de feu se comporte de la manière suivante : durant le premier tiers de sa durée de vie, elle grossit jusqu'à atteindre son diamètre maximal Dmax. Puis, elle garde la même taille, mais s'élève à une vitesse constante, d'une altitude de trois fois son rayon (si la boule a un rayon de 10 m, c.-à-d. un diamètre de 20 m, elle s'élèvera de 30 m de hauteur). Durant la phase de croissance (premier 1/3), la quantité de chaleur émise par la boule de feu est constante (le mélange brûle de manière régulière), puis elle diminue pendant la phase de montée jusqu'à 0 (elle brûle ce qu'il lui reste).
80 à 90 % des éclats tombent à une distance inférieure à 4 fois le rayon de la boule de feu (40 m dans l'exemple ci-dessus). Des fragments dangereux sont projettés jusqu'à une distance égale à 15 fois le rayon de la boule de feu (30 fois dans certains cas rares).
| début |
Pour les véhicules de moins de 3,5 t (voitures de tourisme), le réservoir de GPL fait 150 L (le remplissage est limité à 80 %). La résistance du réservoir est de 80 bars, la soupape de sécurité s'ouvre vers 25 bars.
Dans ces conditions, l'incendie de la voiture peut créer une BLEVE avec :
| début |
Si l'on effectue une simulation avec les hypothèses suivantes (Roberts, DOE) :
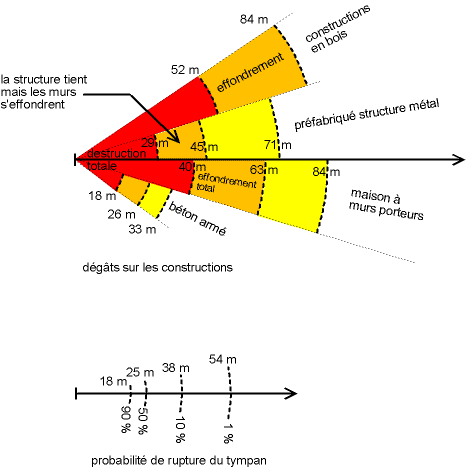
Fig. 5 Effet destructeur du souffle
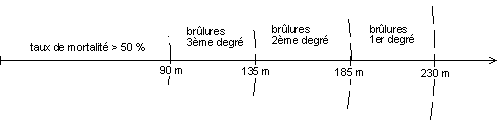
Fig. 6 Brûlure par rayonnement
| début |
La spécificité de l'ébullition-explosion, c'est que l'explosion n'est pas due à une réaction chimique mais uniquement à un phénomène physique, la dépressurisation rapide du réservoir.
On sait qu'un produit peut être présent sous trois formes : solide, liquide ou gazeux. Cet état physique dépend de la pression et de la température. Par exemple, à pression atmosphérique (environ 1 bar, 100 000 Pa), l'eau est solide en-dessous de 0 °C (glace), elle est liquide entre 0 et 100 °C, et elle est gazeuse au-dessus de 100 °C (vapeur).
On ne va s'intéresser ici qu'à deux états : l'état liquide et l'état gazeux. Le passage liquide-gaz s'appelle l'ébullition. L'ébullition de l'eau sous 1 bar se fait donc à 100 °C.
Si l'on augmente la pression, alors l'ébullition se fait à plus haute température. C'est le principe de l'autocuiseur type Cocotte Minute : alors que dans une casserole d'eau, la température maximale est de 100 °C (si l'on monte le feu, l'eau bout plus fort mais la température reste à 100 °C), dans un autocuiseur où la pression est plus forte (environ 1,7 bar), la température d'ébullition est aussi plus forte (environ 120 °C) donc les aliments cuisent plus vite.
À l'inverse, si l'on diminue la pression, l'eau bout à plus basse température. Ainsi, en haute montagne, l'eau bout en-dessous de 100 °C (donc les aliments cuisent mal).
On peut tracer un diagramme : sur un axe on représente la température, sur un autre la pression, et l'on a deux régions, une correspondant à l'état gazeux, l'autre à l'état liquide.
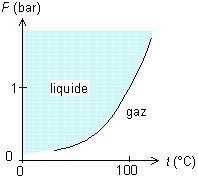
Fig. 7 Diagramme de phase de l'eau
Le diagramme répond à la question suivante : si je suis à une température t et à une pression P, l'eau est-elle liquide ou gazeuse ? Il suffit de regarder dans quelle région se situe le point (t,P). Par exemple, à 1 bar et 20 °C, on voit que l'eau est liquide, et qu'il faut monter au-delà de 100 °C pour qu'elle soit gazeuse, l'ébullition se fait è 100 °C.
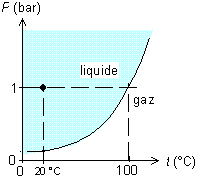
Fig. 8 Exemple d'utilisation du diagramme de phase de l'eau
Autre exemple, à 1,7 bar et à 100 °C, l'eau est-elle liquide ou gazeuse ? Le diagramme nous répond qu'elle est liquide, et que pour être gazeuse à cette pression, il faudrait qu'elle soit à plus de 120 °C ; donc à 1,7 bar, l'ébullition se fait à 120 °C.
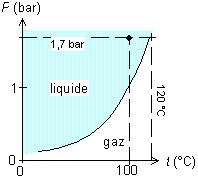
Fig. 9 Autre exemple d'utilisation du diagramme de phase de l'eau
On voit que l'on peut aussi transformer de l'eau liquide en gaz en abaissant la pression. Si l'on met de l'eau dans un récipient fermé, à 20 °C, et que l'on pompe l'air pour faire le vide, on voit qu'en dessous de 0,14 bar, l'eau est à l'état gazeux. Donc, on va voir bouillir l'eau lorsque l'on va atteindre cette pression.
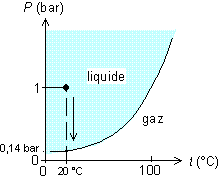
Fig. 10 Ébullition de l'eau à 20 °C
en baissant la pression en-dessous de 0,14 bar
| début |
On peut tracer un tel diagramme pour tous les produits. Ainsi, on voit que si un produit est gazeux à 20 °C sous une atmosphère, il suffit de le comprimer et/ou de le refroidir pour qu'il se transforme en liquide. Cela permet de stocker de grandes quantités de gaz.
Par exemple, à pression atmosphérique (1 bar), le butane est liquide en-dessous de -0,5 °C. Si l'on reste à 20 °, il faut comprimer le butane à environ 3 bar pour qu'il devienne liquide.
À pression atmosphérique (1 bar), le propane est liquide en-dessous de -42 °C. À 20 °C, il faut le comprimer à environ 10 bar pour qu'il soit liquide.
Donc, pour stocker des gaz liquéfiés à température ambiante, il faut plusieurs bars de pression dans la bouteille, le réservoir ou la citerne. On a du liquide en bas, et du gaz en haut du réservoir (ciel gazeux). Lorsque l'on tire du gaz (détente lente), la pression diminue, donc le liquide bout et se transforme en gaz. L'ébullition permet de compenser la perte de gaz, le niveau de liquide diminue, mais la pression reste constante. C'est l'utilisation normale.
Si maintenant il ya une détente rapide, par exemple une fuite, l'ébullition est très violente et provoque une surpression : il y a plus de liquide qui se transforme en gaz que de gaz qui s'échappe. C'est comme cela que se produit l'ébullition-explosion ou BLEVE.
| début |
| début |
Notes
l'air conduit mal la chaleur :
la couche d'air du double-vitrage ou d'une bouteille thermos isole de la chaleur,
le but des poils, des fils de la laine, est d'emprisonner l'air pour isoler
retour