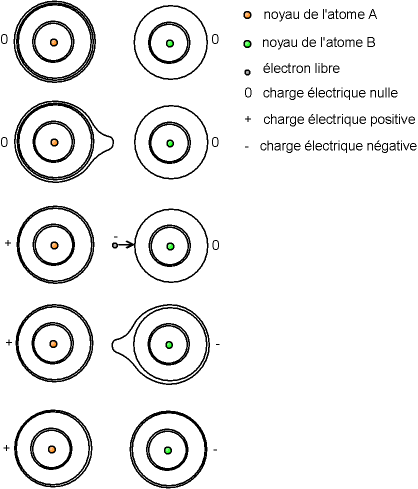
Fig. 5-1 Échange d'électrons entre deux atomes provoquant la création d'un cation et d'un anion
| précédent |
On a donc 103 types d'atomes, 103 éléments.
Chaque élément est désigné
par un code d'une lettre capitale,
ou de deux lettres donc la première est une capitale
et la seconde une miniscule ;
c'est le «symbole chimique».
Par exemple :
l'hydrogène est désigné par H,
le carbone par C,
l'azote par N (du latin nitrum,
le salpêtre),
l'oxygène par O,
le sodium par Na (de l'arabe natrun,
un produit utilisé pour conserver les momies),
le fer par Fe, le calcium par Ca...
En travaillant sur l'électron fraîchement découvert, Robert Millikan, en 1909, découvre que la charge électrique portée par un électron est toujours la même, et il détermine sa valeur, notée -e (e = 1,6.10-16 C). Ainsi, la matière étant habituellement électriquement neutre (elle a une charge globale nulle), si le nuage électronique se compose de Z électrons, il y a Z charges -e, le noyau comporte a donc Z charges +e pour compenser. Depuis la découverte du proton, on sait que la noyau comporte Z protons et que chaque proton a une charge +e.
Z est appelé «numéro atomique», il vaut 1 pour l'hydrogène H, 6 pour le carbone C, 8 pour l'oxygène O... et 103 pour le lawrencium Lw.
Si d'aventure un électron est arraché à l'atome, il y a une charge +e excédentaire, on a ce que l'on appelle un «ion positif» ou «cation». Si par contre l'atome capture un électron qui passait par là, il y a une charge -e excédentaire, on a ce que l'on appelle un «ion négatif» ou «anion». Mais le noyau est inchangé, on a toujours le même élément chimique avec le même numéro atiomique.
Typiquement, il existe des réactions chimiques au cours desquelles les atomes s'échangent des électrons, entraînant la création d'ions, ce sont les réactions dites «électrochimique» ou d'«oxydo-réduction» ; les piles électriques utilisent de telles réactions.

Fig. 5-1 Échange d'électrons entre deux atomes
provoquant la création d'un cation et d'un anion
On peut aussi arracher des électrons mécaniquement ; ainsi, si vous frottez un objet en plastique sur vos cheveux (un peigne, une règle, le corps d'un stylo à bille...), vous créez des ions dans le plastique (c'est ainsi que l'on peut attirer des petits morceaux de papier). Enfin, la lumière peut aussi arracher des électrons, c'est l'effet «photoélectrique», qui permet d'expliquer la modification de certains produits chimiques par la lumière (le bronzage, l'impression des pellicules photographiques, la photosynthèse par la chlorophyle des plantes), le fonctionnement des cellules photovoltaïques (photopiles), les cellules photoélectriques (p.ex. l'ouverture des portes automatiques)...
Les ions sont des atomes qui ont perdu ou gagné un ou plusieurs électrons ; il ne sont plus neutres électriquement.
Comme on ne peut pas diviser la charge e
(il n'existe pas de charge plus petite que e),
on se contente souvent de donner le nombre de charges
+e ou -e en excès,
par exemple, on dira qu'un ion calcium a une charge +2
(il a perdu deux électrons).
Pour distinguer l'ion de l'atome,
on notera la charge en exposant du code désignant l'élément chimique : par exemple
Ca++ ou Ca2+
pour l'ion calcium,
O-- ou O2-
pour l'ion oxygène.
Le concept d'ion est en fait un peu plus complexe, un complément est apporté dans le paragraphe suivant.
| début |
Plutôt que de voler un électron à un autre atome comme dans le cas d'une réaction électrochimique, il peut y avoir une mise en commun d'un électron (chaque atome apporte un électron qu'il partage avec l'autre atome). C'est la liaison moléculaire ou «liaison covalente».
La plupart des atomes ne peuvent exister seuls, dès qu'ils se rencontrent, ils vont se lier par ces électrons en commun, et former une molécule. En fait, seuls quelques gaz rares existent sous forme d'atome isolé : l'hélium He, le néon Ne, l'argon Ar, le krypton Kr et le xénon Xe. En fait, lors de la mise en commun des électrons, la structure des nuages électroniques des atomes devient proche de celle des gaz rares ; la structure des atomes des gaz rares est stable, de même que celle des molécules.
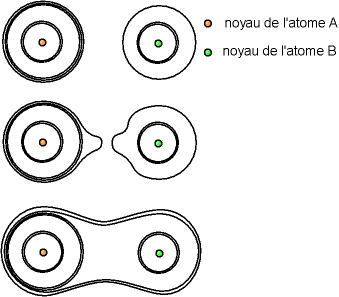
Fig. 5-2 Liaison covalente -
les atomes partagent un électron chacun
On remarque que pour les électrons de liaison, la forme de leur nuage ressemble à une écorce de cacahouète.
Les deux atomes peuvent être identiques, alors, on met un "2" en indice du symbole chimique pour indiquer que la molécule contient deux atomes identiques : p.ex. les gaz dihydrogène H2, dioxygène O2, diazote N2, dichlore Cl2. Les atomes peuvent aussi être différents, on accole alors les deux symboles chimiques : p.ex. le monoxyde de carbone CO, le chlorure d'hydrogène HCl.
Un atome peut partager ses électrons avec plusieurs autres atomes, le carbone peut ainsi partager jusqu'à 4 électrons. Dans le cas de l'eau, l'atome d'oxygène partage deux électrons, un avec chaque atome d'hydrogène : H2O. Dans le cas du méthane, le carbone partage quatre électrons, avec quatre atomes d'hydrogène : CH4. Les atomes peuvent ainsi former une chaîne, comme dans le cas de l'alcool éthylique : CH3CH2OH.
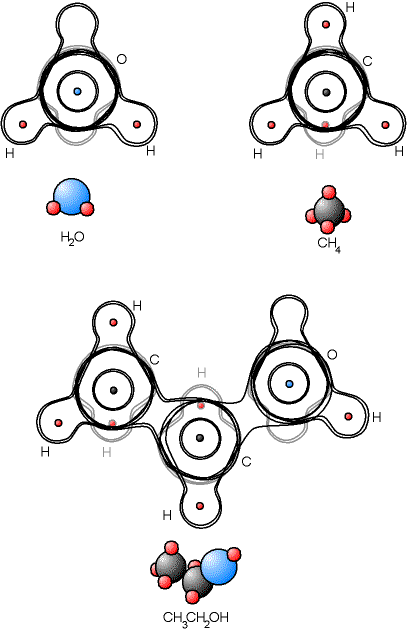
Fig. 5-3 Liaison covalente entre plus de deux atomes -
on représente en-dessous la molécule
avec le modèle des sphères dures
On remarque aussi que la forme des molécules est en 3 dimensions ; dans le cas du carbone, les quatres liaisons sont réparties équitablement dans l'espace, la molécule de CH4 forme donc un tétraèdre. Dans le cas de l'oxygène, le nuage de quatre des électrons de l'atome a la forme d'une écorce de cacahouète bien que les électrons ne servent pas à une liaison ; c'est ce que l'on appelle une «hybridation». Bien qu'il n'y ait que deux atomes liés à l'atome O, les nuages électroniques forment tout de même un tétraèdre.
Cette configuration dans l'espace est assez malaisée à représenter en dessin. Les traits des noyaux et nuages électroniques situés derrière sont en gris dans le dessin ci-dessus. On utilise souvent une notation dite «formule développée», qui permet de montrer l'organisation des atomes entre eux, mais sans la forme de la molécule. Les atomes sont représentés simplement par leur symbole chimique, les liaisons covalentes (les électrons partagés) par des traits, le tout mis à plat.
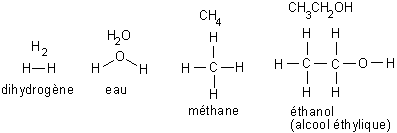
Fig. 5-4 Formules développées pour quelques molécules
Dans certain cas, les atomes mettent chacun deux ou trois électrons en communs. On parle alors de liaisons doubles ou triples. La forme des nuages électroniques est plus complexe, nous allons donc nous contenter de donner la formule développée de quelques exemples.
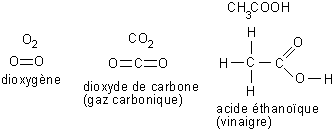
Fig. 5-5 Formules développées pour quelques molécules
comportant des liaisons doubles
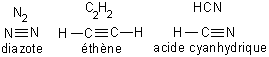
Fig. 5-6 Formules développées pour quelques molécules
comportant des liaisons triples
Nous avons vu le cas de deux atomes mettant un ou plusieurs électrons en commun. Il se peut aussi que plus de deux atomes mettent leurs électrons en commun. On parle alors de «liaison délocalisée». Par exemple, dans le cas du benzène C6H6, les 6 atomes de carbone mettent chacun un électron en commun avec tous les autres. Dans la formule développée, les six électrons de la liaison délocalisée sont représentés par un cercle.
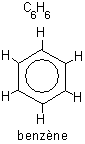
Fig. 5-7 Formule développée du benzène,
comportant une liaison délocalisée ;
les atomes de carbone ont été omis pour plus de clarté,
ils se situent aux sommets de l'hexagone
Maintenant que nous avons vu les molécules, nous allons préciser le concept d'ion.
Le concept d'ion est un petit peu plus compliqué que ce que nous avons vu au paragraphe précédent, en effet, ce n'est pas forcément un atome seul qui perd ou gagne une charge, cela peut être une molécule. Par exemple, dans l'eau, il y a des ions H3O+, c'est un assemblage de trois atomes d'hydrogène H et d'un atome d'oxygène O qui a perdu un électron - c'est l'assemblage qui a perdu un électron, il n'existe pas d'ion H+ se baladant seul dans l'eau. De même, il y a des ions OH- dans l'eau. Il existe aussi des ions carbonate CO32-, des ions phosphate PO43-, des ions sulfate SO42-...
| début |
On sait que les objets ayant une charge opposée s'attirent, et les objets ayant une charge de même signe se repoussent. Les + se repoussent entre eux, les - se repoussent entre eux, mais un + et un - s'attirent (force de Coulomb). Les ions se baladant dans la nature vont donc être attirés par des ions ayant une charge opposée, ils vont former un édifice électriquement neutre.
Cette attraction électrostatique forme ce que l'on appelle la «liaison ionique». Elle est à l'origine de la cristallisation des sels.
Ainsi, les ions sodium Na+ et les ions chlore Cl- s'associent pour former le chlorure de sodium NaCl (édifice neutre), qui n'est autre que le sel de cuisine. Les ions sont empilés en alternance, de sorte qu'un ion + n'est entouré que d'ions -, et un ion - n'est entouré que d'ions +.
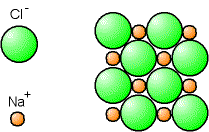
Fig. 5-8 Cristal de sel NaCl
représenté avec le modèle des sphères dures
| début |
La liaison métallique est une sorte de liaison hyper-délocalisée : chaque atome cède un ou plusieurs électrons à l'ensemble du cristal. Ainsi, les électrons sont mis en commun entre plusieurs millions ou milliards d'atomes ! En quelque sorte, on a un nuage électronique continu qui englobe tout le cristal, un «gaz d'électrons».
Ces électrons sont dis «électrons libres». N'étant pas lié à, un endroit du cristal, ces électrons peuvent se déplacer facilement, ce qui explique que les métaux soient d'excellent conducteurs d'électricité.
| début |
Les réactions chimiques sont des réorganisations d'atomes dans les molécules. Les molécules s'échangent des atomes. Il y a donc des liaisons qui se défont et se font.
Pour représenter une réaction chimique, on utilise une «équation de réaction» : les molécules sont notées par les symboles chimique (représentation compacte ou développée), et la transformation est notée par une flèche. Par exemple, la combustion du méthane dans le dioxygène s'écrit :
CH4 + 2 O2 → CO2 + 2 H2Oce qui signifie :
«il y a la rencontre d'une molécule de méthane et de deux molécules de dioxygène ; ces molécules s'échangent leurs atomes, et en fin de réaction, on a une molécule de gaz carbonique et deux molécules d'eau.»Les coefficients entiers donnant le nombre de molécules en jeu sont appelées «coefficients stoechiomètriques» (prononcer "stékiomètriques"). Les molécules placées devant la flèche sont appellées «réactants», les molécules placées après la flèche sont appellées «produits de réaction».
On remarque que le nombre d'atomes de chaque côté de la flèche est identique : un atome C, quatre atomes H et quatre atomes O. C'est la traduction directe du principe énoncé par Lavoisier, la conservation de la matière.
On peut illustrer les échanges d'atomes en se basant sur les formules développées.
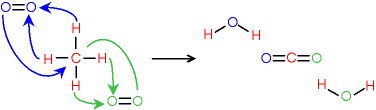
Fig. 5-9 Combustion du méthane dans le dioxygène,
équation de réaction en formules développées ;
les flèches indiquent les échanges d'atomes
entre les réactants ;
les couleurs indiquent, dans les produits de réaction,
de quel réactants proviennent les atomes