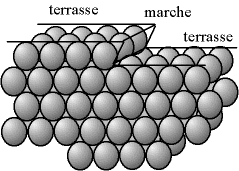
Fig. 4-1 Terrasses et marches : description d'une surface dans le modèle TLK
Les défauts linéaires concernent une séparation entre deux milieux. À l'échelle des atomes, la notion de séparation est assez floue, ne serait-ce que parce que les atomes ne sont pas exactement localisés (notion de fonction d'onde en physique quantique, probabilité de présence). On pourrait voir une interfaces comme un volume de transition entre deux milieux. Cependant, ce volume est tellement mince devant le volume de matière que l'on peut considérer que c'est un plan de dimension deux.
Le premier défaut visible par rapport au cristal parfait
«empilement infini et ordonné d'atomes»est le fait que le volume est fini. Un cristal a donc nécessairement une surface libre, qui est en contact avec l'environnement : air, eau, vide, gaz de combustion, milieu de réaction...
La forme de la surface est décrite par le modèle TLK, pour terraces, ledges, kinks (terrasses, marches, décrochements). Elle comporte en effet

Fig. 4-1 Terrasses et marches :
description d'une surface dans le modèle TLK
On observe également :
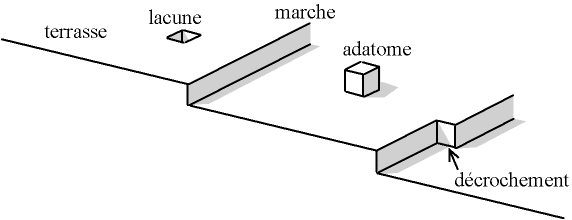
Fig. 4-2 Éléments du modèle TLK
| début |
Un atome (ou ion, mais pour simplifier, on ne parlera que d'atomes par la suite) au sein du cristal a Z voisins, Z étant la «coordinence», qui varie entre 4 (carbone diamant) et 8 (fer α, cubique centré) ; Z = 6 dans un empilement compact (par exemple hexagonal compact ou cubique à faces centrées). Un atome situé à la surface a moins de voisins.
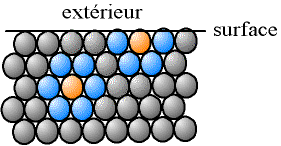
Fig. 4-3 Atomes voisins d'un atome à l'intérieur
et d'un atome sur la surface
Or, si ces atomes forment un cristal, c'est que c'est la forme la plus stable, donc qui a le moins d'énergie, donc qu'un atome entouré de Z autres atomes a une énergie plus faible qu'un atome moins entouré. Donc, les atomes sur la surface libre ont une énergie plus élevée que les atomes dans la matière.
Si l'on considère le problème sous la forme de possibilités de liaison, un atome a Z possibilités de liaison, et lorsqu'il est à la surface, toutes ne sont pas utilisées. Ceci va permettre à d'autres atomes, ions ou molécules de se fixer (phénomène d'«adsorption»).