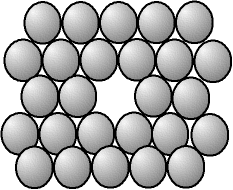
Fig. 2-1 Lacune : absence d'un atome
| précédent |
Les défauts ponctuels concernent un atome. Un atome, me direz-vous, occupe un volume fini, mais ce volume est très faible devant le volume total du cristal, il peut donc être considéré comme un point de dimension zéro.
Une lacune (vacancy en anglais), c'est l'absence d'un atome.

Fig. 2-1 Lacune : absence d'un atome
Certains cristaux sont composés d'ions, c'est à dire que les briques ont une charge électrique positive (cations) ou négative (anions). Dans le cristal parfait, les charges s'équilibrent, il y a autant de charges + que de charges -, il y a une neutralité électrique. Si il manque un cation (charge +), il y a localement plus d'anions (charge -), on a donc localement une charge négative ; une lacune cationique a donc une charge négative, et de même, une lacune anionique a une charge positive.
Il peut sembler curieux de parler de la charge d'un "trou", mais ce n'est qu'une manière pratique de décrire la répartition des charges dans l'espace - et qui plus est, cette manière de voir permet d'expliquer bien et simplement de nombreux phénomènes.
| début |
Un atome ne faisant pas partie de la composition chimique du cristal parfait peut s'y insérer ; il s'agit d'impuretés ou bien d'éléments d'alliage. Il peut prendre la place d'un atome "normal", on dit alors qu'il est en "substitution". Mais, les atomes étant des boules, il reste de la place entre elles (au minimum 36 % de vide, cf. calcul de compacité), un petit atome peut donc se glisser dans les interstices ; l'atome est alors dit "en insertion" ou en "position interstitielle" (pour des raisons de clareté, nous avons écarté les atomes du cristal sur la figure).
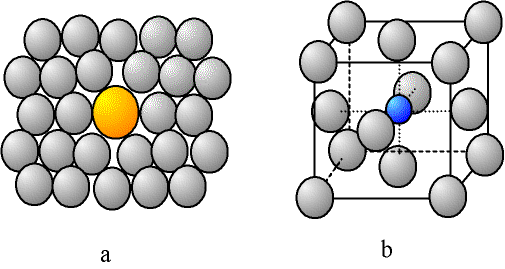
Fig. 2-2 Atomes étrangers :
a - atome en substitution ; b - atome en insertion
Pour désigner la présence d'atomes étrangers, on parle souvent de solution solide. Le terme de solution est traditionnellement associé à la notion de liquide : le sucre se dissout dans l'eau, il est en solution dans l'eau. En fait, les deux phénomènes ne sont pas si différents :
Dans certains cas, un atome du cristal peut être lui-même en insertion, on parle alors d'«auto-insertion».
| début |
Si un cristal est composé de deux (ou plus) types d'atomes différents et que leur disposition est ordonnée (sels, oxydes...), on peut avoir un atome à la mauvaise position. On parle de défaut d'«antiphase» ou d'«antisite».
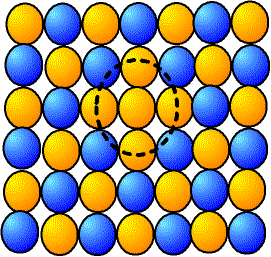
Fig. 2-3 Cristaux ordonnés :
défaut d'antiphase
Si l'alliage est ordonné, c'est qu'une alternance d'atomes ou d'ions différents a une énergie moins élevée que si les espèces de même nature étaient ensemble ; ceci est évident dans le cas d'un cristal ionique, où les charges opposées se neutralisent. L'existence d'un défaut d'antiphase est donc souvent très peu probable, il faut fournir une très grande énergie pour en créer un (par exemple irradiation, ou bien chauffage à haute température).
Notez qu'il existe aussi des alliages désordonnés (les différents types d'atomes n'occupent pas de place privilégiée), dans lesquels le défaut d'antiphase n'existe évidemment pas.
| début |
Pour représenter les défauts ponctuels dans les cristaux, on utilise la notation de Kroger et Vink ; il existe plusieurs notations, mais celle-ci est recommandée par l'IUPAC1.
La notation décrit :
ClCl× -> ClCl• + e'
Notes :
"http://www.iupac.org
retour