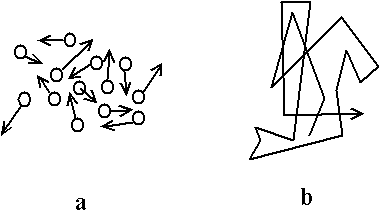
Fig. A.1 - Mouvement Brownien : a - vitesse nulle en moyenne sur tous les grains ; b - mouvement aléatoire et nul en moyenne pour un grain
Les fluides regroupent les liquides et les gaz, par opposition aux solides. Leurs principales propriétés macroscopiques sont :
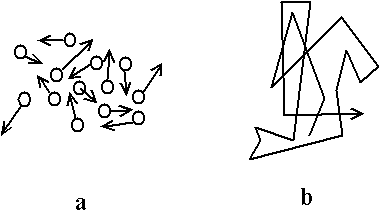
Fig. A.1 - Mouvement Brownien :
a - vitesse nulle en moyenne sur tous les grains ;
b - mouvement aléatoire et nul en moyenne pour un grain
La différence entre les liquides et les fluides est la distance moyenne entre deux chocs, encore appelé libre parcours moyen :
La pression sur une surface est
la force qui résulte des chocs des molécules sur cette surface.
Si l'on considère une quantité donnée de fluide à température ambiante,
la pression augmente lorsque l'on diminue le volume ;
en effet, les molécules sont plus serrées,
les chocs sont donc plus nombreux.
Ceci se voit bien dans le cas d'un gaz,
si l'on prend une pompe à vélo ou une seringue,
qu'on la bouche avec le doigt et que l'on appuie sur le piston,
on réduit le volume et on sent la force qui augmente sur le doigt.
Par contre, si la seringue est remplie de liquide (sans bulle),
on n'aura pas l'impression de voir le volume diminuer lorsque l'on appuie ;
en fait, il diminue mais environs 1000 fois moins que le gaz.
On peut donc dire que l'augmentation de pression s'accompagne d'une augmentation de la densité, mais que celle-ci est insensible dans le cas des liquides.
Il peut y avoir dans les fluides un mouvement de masse, les molécules ont alors toujours un mouvement aléatoire, mais avec une tendance. On parle de courant dans le cas général (liquides ou gaz), et de vent dans le cas de l'air de l'atmosphère.
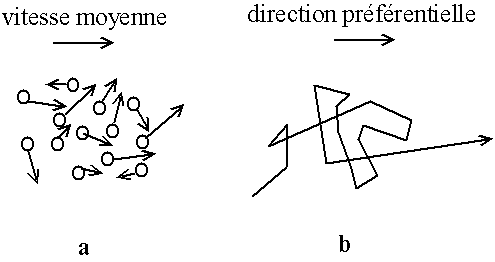
Fig. A.2 - Courant :
a - vitesse moyenne sur tous les grains non nulle ;
b - mouvement aléatoire avec direction préférentielle pour un grain
On voit bien là la différence entre les ondes de pression, qui résultent de micro-déplacements, et les courants, qui résultent de mouvements globaux.
Note
1 - Robert Brown, botaniste britannique (1773-1858)
retour
Les solides sont durs et difficilement déformables, bien que ces paramètres varient grandement d'un matériau à l'autre : les élastiques (bracelets de caoutchouc) sont plutôt mou et s'étirent facilement, contrairement aux roches ou aux métaux. Mais un élastique est toujours plus dur et plus rigide qu'un liquide ou un gaz... Disons que les solides ont une cohérence, une texture, contrairement aux fluides qui sont "fuyants".
Les solides sont eux aussi constitués de "grains de sables" (molécules, atomes ou ions), mais ceux-ci sont cette fois-ci "soudés", ils sont immobiles les uns par rapport aux autres. En fait, ils ne sont pas tout à fait immobiles, ils peuvent bouger, "s'agiter" autour de leur position, c'est comme s'ils éraient reliés entre eux par des ressorts très puissants.
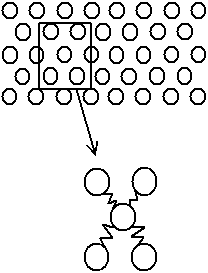
Fig. A.3 - Solide :
les grains sont liés entre eux par des ressorts
Par comparaison avec les fluides, on peut dire que leur libre parcours moyen des grains est petit devant leur taille (les grains sont quasiment en permanance au contact). Leur densité est d'ailleurs très grande devant celle des gaz, et souvent grande devant celle des liquides, environs 7 kg par litre dans le cas du fer ; certains solides peuvent cependant être moins denses que l'eau, comme certains bois ou plastiques, ou bien être plein de "bulles", ce qui les allège (mousse, pierre ponse).
La notion de pression est ici différente de celle des fluides : la force exercée sur une surface est due à la répulsion des atomes (deux atomes ne peuvent pas occuper la même place). Donc, pour une quantité donnée de matière à température ambiante, la pression augmente lorsque les atomes sont plus serrés, c'est à dire l'on diminue le volume, mais cette diminution est environ 1000 fois plus faible que dans le cas des liquides.
Certaines ondes se propagent à la surface d'un liquide ou d'un solide, c'est à dire à une interface liquide/gaz (cas des vagues sur l'eau), où à l'interface solide/gaz (ondes sismiques de Love et de Rayleigh) ou solide/liquide (idem mais sous l'eau). On pourrait aussi imaginer une interface entre deux liquides non miscibles (vague entre l'huile et le vinaigre).
L'interface est donc en elle-même un milieu de propagation. En fait, elle se comporte elle-même comme une membrane élastique : elle est normalement plane, et lorsque qu'on la perturbe, elle tend à le redevenir. Il y a trois phénomènes simples à l'origine de cette élasticité :
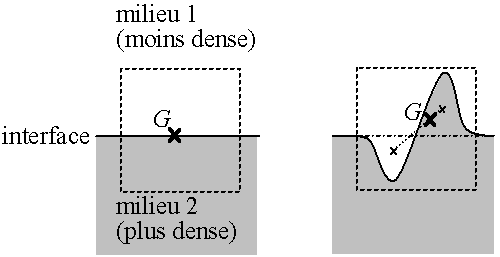
Fig. A.4 - Interface,
augmentation de l'énergie potentiele de gravité
lors d'une déformation
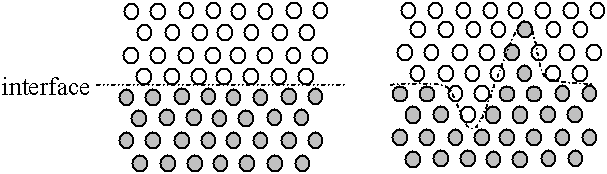
Fig. A.5 - Interface,
augmentation de la surface de contact --
et donc de l'énergie d'interface --
lors d'une déformation
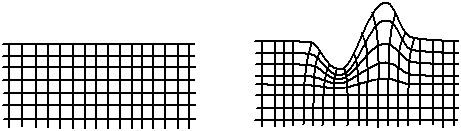
Fig. A.6 - Interface,
étirement et compression --
et donc augmentation de l'énergie élastique --
lors d'une déformation
Les interfaces sont également les lieux où se passe la réfraction.
Une interface est la frontière entre deux milieux. Il y a donc un changement brusque, discontinu, des propriétés physiques, principalement en ce qui nous concerne :